近日,西北工业大学生命学院张连兵教授团队开发出一种新型“光动力+光免疫”联合治疗策略,利用蓝光调控黑色素瘤的MHC-I表达,并协同Cu@ferrihydrite诱导铁-铜死亡和系统免疫响应,用于黑色素瘤的治疗与预防。该研究成果以“Melanoma MHC-I-membrane-encapsulated Cu@ferrihydrite induces ferroptosis/cuproptosis and systematic immunity against tumor”为题发表于国际知名期刊《Journal of Controlled Release》 (医学1区TOP,IF:11.5)。

作为肿瘤细胞与T细胞之间免疫识别的分子基础,主要组织相容性复合体I(Major histocompatibility complex I,MHC-I)控制着免疫监视的启动阶段,其表达量直接决定了机体免疫细胞(特别是T细胞)对肿瘤细胞的清除效率。然而,在肿瘤的免疫抑制微环境中,低表达的MHC-I使肿瘤细胞无法被免疫细胞有效识别并清除,从而延误肿瘤的治疗。
为此,张连兵教授团队首次发现蓝光能够通过调控NF-κB-SUSD6信号轴显著上调黑色素瘤细胞MHC-I的表达,从而增强其免疫原性,使黑色素瘤细胞更易被免疫细胞(如树突状细胞和巨噬细胞)识别和攻击。基于此发现,研究人员巧妙设计并合成了一种新型纳米颗粒M-Cu@Fh。该颗粒以蓝光响应性的Cu@ferrihydrite(Cu@Fh)为核心,外层包覆了富含MHC-I的黑色素瘤细胞膜。在蓝光照射下,M-Cu@Fh可控制性地释放Fe⟡⁺和Cu⟡⁺,在肿瘤细胞内引发强烈的氧化应激并诱导线粒体功能紊乱,从而导致黑色素瘤细胞的铁死亡(Ferroptosis)和铜死亡(Cuproptosis)。更为重要的是,M-Cu@Fh的MHC-I分子能有效促进树突状细胞成熟和巨噬细胞抗肿瘤极化,继而激活CD8⁺和CD4⁺ T细胞,启动有效的抗肿瘤免疫应答。动物实验表明,该联合疗法不仅能显著抑制原位黑色素瘤的生长,还能在淋巴器官和肺部激活系统性的免疫记忆,有效阻止肿瘤的远端转移,展现出类似“肿瘤疫苗”的预防效果。该研究不仅首次阐明了蓝光通过NF-κB-SUSD6轴调控MHC-I的分子机制,更构建了一个集光动力疗法(Photodynamic therapy,PDT)与光免疫疗法(Photo-immunotherapy,PIT)于一体的协同治疗平台,为癌症的联合治疗与转移防控开辟了新的途径。
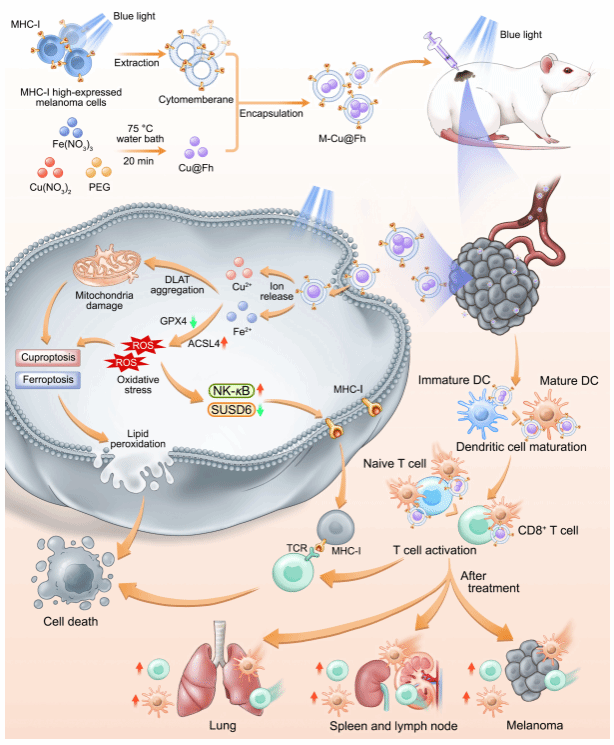
图1:蓝光+M-Cu@Fh启动” PDT+PIT”联合治疗策略的作用机制
西北工业大学生命学院为文章第一单位,第一作者为博士研究生杨荣,张连兵教授和郑州大学第一附属医院程根阳教授、西安医学院第一附属医院杨迎春博士为文章的共同通讯作者。上述研究工作得到国家自然科学基金面上项目、中国博士后基金面上项目的支持。
文章链接:https://doi.org/10.1016/j.jconrel.2025.114281.
(图、文:杨荣;审核:杨慧)